發(fā)布時(shí)間:2022-03-06所屬分類(lèi):農(nóng)業(yè)論文瀏覽:1次
摘 要: 摘要:三相分離(TPP)是將硫酸銨與叔丁醇混合后形成有機(jī)相、中間沉淀相和水相。在20。C,調(diào)節(jié)發(fā)酵上清波的pH至6.o,加入硫酸銨使終濃度為400 g/L,溶解后加入與上清液等體積的叔丁醇,靜置1 h分相,膽固醇氧化酶在有機(jī)相和水相之間形成蛋白沉淀,12 ooo r/min離心10 min
摘要:三相分離(TPP)是將硫酸銨與叔丁醇混合后形成有機(jī)相、中間沉淀相和水相。在20。C,調(diào)節(jié)發(fā)酵上清波的pH至6.o,加入硫酸銨使終濃度為400 g/L,溶解后加入與上清液等體積的叔丁醇,靜置1 h分相,膽固醇氧化酶在有機(jī)相和水相之間形成蛋白沉淀,12 ooo r/min離心10 min 收集中間蛋白相,用pH 7.5,10 mmol/L的磷酸緩沖液溶解。結(jié)果表明;利用三相分離技術(shù)從乳化體系中分離純化膽固醇氧化酶,比酶活提高了3.49倍,收率迭93%。回收的酶液進(jìn)一步經(jīng)過(guò) DEAE—Sepharose Fast Flow純化,比酶活從3.56 U/mg提高到30.15 U/mg。該酶最適反應(yīng)溫度為60。C,最適反應(yīng)pH為7.5,酶的等電點(diǎn)為8.5,該酶在37。C,pH 6.o~8.o較為穩(wěn)定。H92+和 Ag+離子完全抑制膽固醇氧化酶的活性。
關(guān)鍵詞:甾短桿菌;膽固醇氧化酶;分離純化;三相分離;酶學(xué)性質(zhì)
膽固醇氧化酶(ECl.1.3.6,COD)是依賴(lài)輔酶 FAD,能專(zhuān)一性地催化膽固醇轉(zhuǎn)化為膽甾一4一烯一3一酮‘¨,在食品開(kāi)發(fā)、醫(yī)療保健、臨床檢測(cè)、生物農(nóng)藥等方面具有廣泛應(yīng)用價(jià)值。產(chǎn)膽固醇氧化酶的微生物有多種,如節(jié)桿菌、馬紅球菌、諾卡氏菌、假單胞菌、鏈霉菌,不同來(lái)源的膽固醇氧化酶的生理特性及底物特異性不同[2]。本實(shí)驗(yàn)室從土壤中篩選得到一株膽固醇氧化酶生產(chǎn)菌B卯口i施c£eri“m sp.DGCDC82[3‘。
膽固醇和酵母膏是生產(chǎn)膽固醇氧化酶的最佳碳源和氮源[4]。因此膽固醇在培養(yǎng)基中的分散效果是影響產(chǎn)酶的重要因素。利用表面活性劑乳化膽固醇對(duì)產(chǎn)酶有重要作用D]。本實(shí)驗(yàn)室利用表面活性劑 Tween一80、異丙醇和橄欖油乳化膽固醇對(duì)產(chǎn)酶有顯著作用印]。這主要是因?yàn)樘岣吡四懝檀荚谂囵B(yǎng)基中乳化穩(wěn)定性促進(jìn)了它的分散效果,從而促進(jìn)了它對(duì) B化口i施f£P(guān)一“優(yōu)sp.DGCDC-82產(chǎn)酶的誘導(dǎo)效果。
在膽固醇氧化酶的提取過(guò)程中,硫酸銨鹽析是最常見(jiàn)的方法[7~8]。但是在作者的實(shí)驗(yàn)過(guò)程中,由于殘留的膽固醇、Tween-80和橄欖油形成穩(wěn)定的混合物,而且與膽固醇氧化酶親合在一起,因此利用硫酸銨鹽析無(wú)法有效地將膽固醇氧化酶從乳化體系中分離出來(lái)。
三相分離(TPP)是一個(gè)簡(jiǎn)單的技術(shù),鹽和有機(jī)溶劑添加到發(fā)酵上清液中[9]。一個(gè)小時(shí)后三相形成。上相是有機(jī)相(包含非極性化合物),下相是水相(包含極性化合物),中間層為蛋白質(zhì)沉淀。作者利用三相分離技術(shù)分離膽固醇氧化酶,膽固醇、 Tween一80、橄欖油及色素富集在上相,而酶蛋白濃縮在中間相。這樣既有效地破除了乳化體系又可以達(dá)到濃縮純化的效果。雖然成本比硫酸銨鹽析略高,但是純化倍數(shù)和收率都比較高。
本文報(bào)道了用三相分離和離子交換技術(shù)從乳化體系中分離純化膽固醇氧化酶,并對(duì)純酶的酶學(xué)性質(zhì)進(jìn)行了研究。
1實(shí)驗(yàn)材料和方法
1.1材料
1.1.1 茵種 BrP口i6口f£P(guān)ri“,扎 sp.CCTCC M201008,由本實(shí)驗(yàn)室保藏。
1.1.2培養(yǎng)基種子培養(yǎng)基(g/L):牛肉浸膏3,蛋白胨10,NaCl 5。發(fā)酵培養(yǎng)基(L):膽固醇4 g,酵母膏8.5 g,NaCl 1 g,CH3C00NH4 4 g,K2HP04 O.2 g,MgSQ 0.05 g,F(xiàn)eSOl O.01 g,CaCl2 0.1 mL,Tween-80 3 mL。以上培養(yǎng)基pH調(diào)至7.5左右,然后于O.1 MPa下滅菌15 min。
1.1.3 主要生化試劑 DEAE—Sepharose Fast F10w(Pharmacia公司);牛血清蛋白、SDS、丙烯酰胺、N,N,_2亞甲基雙丙烯酰胺,分析純,分子量標(biāo)準(zhǔn)蛋白、等電點(diǎn)標(biāo)準(zhǔn)蛋白均購(gòu)自Sigma公司;其他生化試劑均為國(guó)產(chǎn)分析純。
1.2方法
1.2.1 培養(yǎng)條件 斜面活化48 h,種子在37。C, 220 r/min振蕩培養(yǎng)14~16 h。發(fā)酵條件:500 mL 三角瓶裝液量為100 mL,接種量5%,溫度37。C, 220 r/min。
1.2.2膽固醇氧化酶活力的測(cè)定 原理:膽固醇在膽固醇氧化酶(COD)的催化下分解成一分子的膽甾一4一烯一3一酮和一分子的H。O。,H:Oz在過(guò)氧化物酶的作用下分解,可使4一氨基一安替比林與苯酚形成亞醌類(lèi)呈紅色的化合物,它在500 nm處有最大吸收峰,通過(guò)測(cè)量反應(yīng)液在500 nm處的吸光值,可定量測(cè)定膽固醇的氧化量,從而計(jì)算出膽固醇氧化酶的酶活單位口]。
操作方法[31:3 mL溶液A(4一氨基一安替比林1 mmol/L,苯酚6 mmol/L,疊氮鈉o.2 g/L,過(guò)氧化物酶5 ooO U/L,磷酸鉀緩沖液25 mmol/L pH 7.5),150“L溶液B(膽固醇8.26 mg/mL,Triton X一100 9=o.042 6,異丙醇為溶劑),50弘L酶液, 37。C反應(yīng)5 min,沸水浴3 min,于500 nm測(cè)吸光度。酶活(U/mL)=1.683 2×A500。
1.2.3蛋白質(zhì)濃度的測(cè)定 按Lowry法[10]測(cè)定,以牛血清白蛋白作標(biāo)準(zhǔn)。
1.2.4 酶的分離與純化 (1)不同種類(lèi)有機(jī)溶劑三相分離效果的比較:室溫條件下,在30 mL發(fā)酵上清液中加入硫酸銨,使硫酸銨的終濃度達(dá)到300 g/ L,將等體積的有機(jī)溶液加入上述溶液中,靜置分相,12 ooo r/min離心10 min,收集中間相,用10 mL pH 7.5的50 mmol/L的磷酸緩沖液溶解后按照標(biāo)準(zhǔn)方法測(cè)定酶活和蛋白質(zhì)濃度。(2)溫度和時(shí)間對(duì)三相分離效果的影響:改變提取溫度,以上述相同方法收集中間相測(cè)定酶活和蛋白質(zhì)濃度。(3)pH 對(duì)三相分離效果的影響:改變pH,其他條件不變,以上述相同方法收集中間相測(cè)定酶活和蛋白質(zhì)濃度。(4)硫酸銨濃度對(duì)三相分離效果的影響:20 oC, pH 6.o的條件下,在30 mL發(fā)酵上清液中加入不同濃度的硫酸銨,其他條件和操作方法同上,收集中間相測(cè)定酶活和蛋白質(zhì)濃度。(5)叔丁醇濃度對(duì)三相分離效果的影響:20。C,pH 6.o的條件下,在30mL發(fā)酵上清液中加入硫酸銨、使終濃度為400 g/ L,將叔丁醇以不同的比率加入到發(fā)酵上清液中,以上述相同方法收集中間相測(cè)定酶活和蛋白質(zhì)濃度。 (6)離子交換柱操作條件:經(jīng)三相分離處理,并將透析后的酶液加到已用pH 8.0的10 mmol/L Tris緩沖溶液平衡的離子交換層析柱(2.o cm×40 cm),先用pH 8.O的Tris緩沖溶液洗柱,再用線(xiàn)性梯度的緩沖液梯度洗脫。平衡和進(jìn)樣流速為2 mL/min;洗脫流速為3 mL/min;每管收集6 mL,將活性部分收集.
1.2.5酶學(xué)性質(zhì) (1)最適反應(yīng)溫度及熱穩(wěn)定性:在不同溫度下按照標(biāo)準(zhǔn)方法測(cè)定酶活,以酶活最高者為100%;酶液分別在65、60、55、50、45、37。C下保溫15 min,迅速冷卻至室溫,按標(biāo)準(zhǔn)方法,測(cè)殘余酶相對(duì)活力,以未保溫的酶液的酶活為100%。 (2)酶的最適反應(yīng)pH及pH穩(wěn)定性:將酶液分別加在pH 5.5~8.5的o.1 mol/L的磷酸緩沖液中,按標(biāo)準(zhǔn)方法測(cè)酶活力,以酶活最高者為100%;將酶液用pH 5.5~10.O的緩沖液稀釋?zhuān)?5。C保溫20 h 后,測(cè)殘余酶活力,以未保溫的酶液的酶活力 100%。(3)等電點(diǎn)測(cè)定:凝膠的濃度75 g/L,載體兩性電解質(zhì)的pH為3.5~10.O,蛋白質(zhì)染色用o.5 g/L考馬斯亮藍(lán)R-250溶液[1¨。(4)金屬離子對(duì)酶活力影響:用10 mmol/L磷酸緩沖液(pH 7.O)配成含2 mmol/L不同金屬離子的緩沖液,與一定量酶液在25。C保溫1 h后,測(cè)定膽固醇氧化酶活力。以不含金屬離子反應(yīng)液為對(duì)照。
2實(shí)驗(yàn)結(jié)果與討論
2.1 三相分離條件的優(yōu)化
三相分離是一個(gè)簡(jiǎn)單而且易于放大的預(yù)處理粗酶液的方法,而且不象硫酸銨鹽析那樣在下一步的離子交換之前必須透析脫鹽,三相分離常常可以省略透析脫鹽[12。。影響三相分離效果的因素很多,包括酶蛋白的特性、酶蛋白濃度、pH、離子強(qiáng)度、提取溫度、有機(jī)溶劑類(lèi)型以及處理時(shí)間等。因此有必要研究這些因素對(duì)三相分離效果的影響,并對(duì)三相分離條件進(jìn)行優(yōu)化。
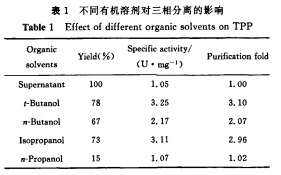
2.1.1 不同有機(jī)溶劑對(duì)三相分離的影響 由表1 可知三相分離純化膽固醇氧化酶時(shí)使用叔丁醇作溶劑的收率和比酶活都是最高的,這與Sharma報(bào)道的一致[1 3。。這可能是因?yàn)槭宥〈嫉姆肿哟笮『头种Y(jié)構(gòu),使其不容易滲透進(jìn)入到酶蛋白的折疊結(jié)構(gòu)內(nèi)部。因此不容易引起酶蛋白變性失活[1引。雖然很多關(guān)于三相分離的報(bào)道中都是利用叔丁醇作為有機(jī)溶劑,但是也有報(bào)道利用其他有機(jī)溶劑如四氫呋喃等進(jìn)行三相分離取得較好的結(jié)果m1。
2.1.2 不同提取溫度和時(shí)間對(duì)TPP效果的影響三相分離的溫度和時(shí)間是兩個(gè)重要的物理參數(shù)。由于這兩個(gè)參數(shù)理論上與其他的物理參數(shù)如鹽離子強(qiáng)度、pH和溶劑濃度相比,對(duì)三相分離效果的影響較小,所以作者對(duì)這兩個(gè)因素先進(jìn)行了確定。提取時(shí)間和提取溫度對(duì)三相分離效果的影響如圖1。由圖可知,較低的溫度傳質(zhì)速率較低,三相形成時(shí)間較長(zhǎng),增加了酶蛋白與有機(jī)溶劑接觸的機(jī)會(huì),引起酶蛋白變性。但溫度太高容易使酶變性失活。從圖1中可以看出延長(zhǎng)提取時(shí)間(即100 min)在較高溫度時(shí) (即30。C)收率明顯下降。基于以上研究結(jié)果,最適的提取時(shí)間和提取溫度為20。C,60 min。
2.1.3 pH對(duì)三相分離效果的影響 在三相分離操作前首先要調(diào)節(jié)發(fā)酵上清液的pH,因?yàn)槿喾蛛x與傳統(tǒng)的硫酸銨鹽析不同,傳統(tǒng)的硫酸銨鹽析時(shí),遠(yuǎn)離等電點(diǎn)處溶解度大,在等電點(diǎn)處溶解度小,因此用中性鹽沉淀蛋白質(zhì)時(shí),pH常選在該蛋白質(zhì)的等電點(diǎn)附近。但是三相分離在等電點(diǎn)附近時(shí)硫酸鹽的陰離子與陽(yáng)離子的酶蛋白的靜電相互作用發(fā)生急劇下降,所以三相分離效果受到明顯的影響[1引。可以利用這一特性,先調(diào)節(jié)pH和硫酸銨濃度沉淀雜蛋白,再調(diào)節(jié)pH和硫酸銨濃度沉淀目的蛋白,達(dá)到分級(jí)沉淀的目的。從圖2可以看出,pH 6.o時(shí)收率和比酶活都比較高,因此,三相分離操作前pH應(yīng)調(diào)節(jié)到6.0左右。
2.1.4硫酸銨濃度對(duì)三相分離效果的影響 硫酸銨不但具有較強(qiáng)的親水性,而且由于Hofmeister效應(yīng),對(duì)酶蛋白結(jié)構(gòu)具有穩(wěn)定作用m]。一般情況下,叔丁醇和水是完全互溶的。但是當(dāng)加入足夠的硫酸銨后,就會(huì)分為兩相,上相叔丁醇相和下相水相。如果最初的溶液中含有酶蛋白,則隨著硫酸銨濃度的增加中間的酶蛋白相將逐漸形成。這是利用三相分離技術(shù)分離純化蛋白的基礎(chǔ)。由圖3可以看出,當(dāng)硫酸銨濃度為400 g/L時(shí)比酶活最高,且收率達(dá) 92%。
2.1-5叔丁醇濃度對(duì)三相分離效果的影響 雖然硫酸根是一個(gè)二價(jià)的陰離子而叔丁醇是中性分子,但是在三相分離體系中,它們能夠相互加強(qiáng)彼此的物化作用口引。從圖4中可以看出,上清液與叔丁醇體積比為1:1時(shí),收率和比酶活最高。增加叔丁醇濃度,收率和比酶活都會(huì)下降,這可能是因?yàn)檩^高濃度有機(jī)溶劑容易引起酶蛋白失活。
相關(guān)知識(shí)推薦:2021年發(fā)表過(guò)的三相分離相關(guān)論文
由以上的實(shí)驗(yàn)結(jié)果可知最優(yōu)的三相分離條件為:20。C,調(diào)節(jié)發(fā)酵上清液pH到6.O,加入的硫酸銨使硫酸銨終濃度為400 g/L,溶解后加入與上清液等體積的的叔丁醇,靜置1 h分相,12 ooo r/min 離心10 min收集中間蛋白相,用pH 7.5,10 mmol/ L的磷酸緩沖液溶解,在此條件下收率和比酶活分別為93%和3.56 U/mg。
2.2離子交換色譜
將經(jīng)過(guò)三相分離處理后的發(fā)酵上清液進(jìn)一步用 DEAE離子交換柱純化,如圖5。將發(fā)酵上清液, TPP處理后的酶液和DEAE純化后的酶蛋白經(jīng) SDs_PAGE檢測(cè),結(jié)果顯示TPP不但可以破除乳化體系,同時(shí)還具有部分純化的作用;樣品經(jīng)DEAE 進(jìn)一步純化后,酶蛋白達(dá)到電泳純。如圖6所示。整個(gè)純化結(jié)果如表2所示。
2.3膽固醇氧化酶部分酶學(xué)性質(zhì)
2.3.1 最適反應(yīng)溫度及熱穩(wěn)定性 實(shí)驗(yàn)結(jié)果表明,酶在37。C保溫15 min殘留98%的活力,高于 65。C時(shí)酶活力,說(shuō)明該酶對(duì)高溫敏感,酶的最適反應(yīng)溫度為60 oC。
2.3.2 最適反應(yīng)pH及pH穩(wěn)定性 由實(shí)驗(yàn)結(jié)果可知,該酶在pH 6.O~8.O比較穩(wěn)定;該酶的最適反應(yīng)pH為7.5。
2.3.3等電點(diǎn)測(cè)定 經(jīng)等電聚焦電泳測(cè)定膽固醇氧化酶的等電點(diǎn)為8.5(室溫)。
2.3.4金屬離子對(duì)膽固醇氧化酶活性的影響 結(jié)果見(jiàn)表3。多種金屬陽(yáng)離子對(duì)該酶都有不同的影響,其中H92+和Ag+離子具有顯著抑制膽固醇氧化酶活性的作用。
3 結(jié)論
用三相分離從乳化發(fā)酵液中分離純化膽固醇氧化酶,優(yōu)化后的三相分離條件為:在20。C,調(diào)節(jié)發(fā)酵上清液的pH至6.o,加入硫酸銨使終濃度為400 g/L,溶解后加入與上清液等體積的叔丁醇,靜置 1 h分相,12 ooO r/min離心10 min,收集中間蛋白相,用pH 7.5,10 mmol/L的磷酸緩沖液溶解。經(jīng)三相分離純化后,膽固醇氧化酶的比酶活提高了 3.49倍,收率達(dá)93%。回收的酶液進(jìn)一步經(jīng)過(guò) DEAEISepharose Fast Fow純化,比酶活從3.56 U/mg提高到30.15 U/mg,收率為64%。對(duì)純酶的酶學(xué)性質(zhì)研究結(jié)果表明:該酶最適反應(yīng)溫度為 60。C,最適反應(yīng)pH為7.5,酶的等電點(diǎn)為8.5,該酶在37℃,pH 6.o~8.o較為穩(wěn)定。H92+和Ag+ 離子完全抑制膽固醇氧化酶活性。——論文作者:王龍剛, 梁爽, 王武
參考文獻(xiàn):
[1]呂陳峰,陳毅力,王龍剛,等.利用膽固醇氧化酶轉(zhuǎn)化膽固醇制備膽甾一4一烯一3一酮[J].無(wú)錫輕工大學(xué)學(xué)報(bào)。200l,20(5): 485—488.
[2]MacLachlan J,wothersp00n A T,Allsell R o,以“.Cholesteml o】【idase:S0urces,physical properti盼and analytical applications [刀.J Steroid Biochem Md Bi01,2000,72:169—195.
[3] 王龍剛,呂陳峰,王 武.Brevibacterium sp.DGCDD82發(fā)酵罐中生產(chǎn)膽固醇氧化酶[刀.無(wú)錫輕工大學(xué)學(xué)報(bào),2003,22 (2):35—37.
[4]LeeMT,Chellwc,choucC Nutritional觸orstht affect the production of cholester01 o五dase by R^odwocc郴∞“no.23 口].Biotechnol Appl Bioch鋤,1997,26:159一162.
[5] Buckland B C。LilIy M D,Dunnill P.The kinetics of choles— ter01 o)【idase synthesis by Nocnrd誼砌odoc^roⅣ5[J]. Bio— techn01 Bioeng,1976,18:60卜621.
[6] Ln c F,wang w,Tang Y x,ef口f.Effect of cholesteroI bio— availability.improving factors on choIesterol oxidase produc— tion by a mutant Bre可i6ncfP一“m sp.DGcDc-82[J].Process Biochem,2002,37:90l一907.
[7] Lartillot s,Kedziora P. Production,puri“cation and some properties of cholesterol o】【idase from a StMp£o聊yces sp.[J]. Prep Biochem,1990,20:5l一62.
[8] Machang R s,Pfescott J F. Purification and properties of cholesterol oxidase and choline phosphohydr01ase fmm R^odD∞ff“s£口“[J].Can J Vet Res,199l。55:332—340.
[9] Roy I,shama A,Nath M,甜口z.Recovery of bioIo舒caI activity ill reversibly inactivated proteins by three phase parti— tioning[J]. E眥yme&Micmbial Technology,2005,37: 113一120.